
2009届江苏省华罗庚中学高三期末模拟试题
一.选择题(每题只有一个正确答案,每题3分,共24分)
1.下列说法正确的是
A.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高于河水
B.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖
C.不可用铝制餐具长时间存放酸性、碱性食物
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
2.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12mol 电子转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
3.阿伏加德罗常数为NA,下列说法中正确的是
A.
B.
C.1
mol CO2与含1 mol NaOH的溶液反应后,溶液中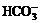 离子数为NA
离子数为NA
D.Na2O2与H2O反应,常温常压下生成16 gO2,反应中转移电子数为NA
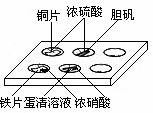 4.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
4.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色
A.①④ B.②③ C.①⑤ D.②⑤
5.利用下列实验装置完成相应的实验,能达到实验目的的是
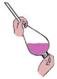
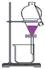
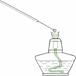
A.检验溶液中是否含有NaCl B.除去乙醇中溶有的少量乙酸
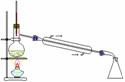

C.实验室中制取少量蒸馏水 D.用MnO2和浓盐酸制备Cl2
6.已知热化学方程式C2H2 (g) + 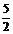 O2 (g)= 2CO2 (g) + H2O (g);ΔH= -1256 kJ/mol,下列说法正确的是
O2 (g)= 2CO2 (g) + H2O (g);ΔH= -1256 kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256 kJ /mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol 液态水,则ΔH = -2512 kJ/mol
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
7.下列相对应的离子方程式不正确的是
A.明矾溶于水后,溶液呈酸性: Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
B.用醋酸除去水垢中的碳酸盐: 2CH3COOH+CO32- 2CH3COO-+H2O+CO2↑
2CH3COO-+H2O+CO2↑
C.工业上电解食盐水制备Cl2: 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.用足量NaOH溶液吸收SO2: 2OH-+SO2 SO32-+H2O
SO32-+H2O
8.常温下,0.1 mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中水电离出的c(H+)=1×10-10 mol?L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol?L-1
C.该溶液与0.05 mol?L-1 NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
二.选择题(每题有一个或两个正确答案,每题4分,共24分)
9.X、Y、Z为短周期元素,原子序数依次增大。X的最外层电子数是Y原子最外层电子数的2 倍,质子数比Y少5,X和Z在同一主族。下列叙述不正确的是
A.原子半径:Y>Z
B.X元素的一种单质可用于消毒杀菌
C.Y的氧化物是工业制取Y单质的主要原料
D.Z的单质在氧气中点燃可生成两种酸性氧化物
10.聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性。以下是我国化学家近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基)
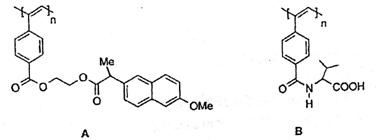
下列关于上述高分子的说法不正确的是
A.A和B均能在一定条件下水解,且水解形成相同的高分子
B.A中药物小分子羧酸的分子式为C16H18O4
C.B分子一个链节的化学式为C14H16NO3
D.A和B各1mol与热碱液反应,均最多消耗2n mol NaOH
11.保持恒温、恒容,在某密闭容器中发生反应: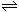 C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ――从正反应开始,A、B的起始物质的量均为2mol
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ――从正反应开始,A、B的起始物质的量均为2mol
Ⅱ――从逆反应开始,C、D的起始物质的量分别为2mol和6mol。以下叙述中正确的是
A.Ⅰ、Ⅱ两种途径从反应开始到平衡状态所消耗的时间相同
B.Ⅰ、Ⅱ两种途径从反应开始到平衡状态的过程中,体系的总密度始终保持不变
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的物质的量分数相同
D.Ⅰ、Ⅱ两途径最终达到平衡时,体系内A的浓度相同
12.下图是化学能与电能相互转换的两套装置。对此两套装置的分析正确的是
A.两装置中,铁电极上均有气体产生
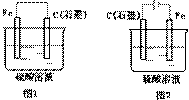 B.图2装置能将电能转化为化学能
B.图2装置能将电能转化为化学能
C.石墨电极上发生的电极反应均为:2H++2e-=H2↑
D.随着反应的进行,两装置中电解质溶液的pH均增大
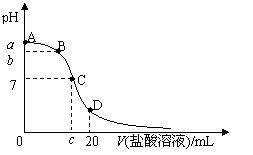
13.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中: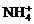 、
、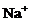 、
、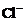 、Br-
、Br-
 B.在强碱性溶液中:
B.在强碱性溶液中: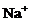 、
、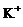 、
、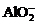 、
、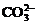
C.在pH=1的溶液中: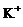 、
、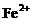 、
、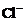 、
、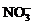
D.在无色透明溶液中: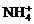 、
、 、
、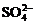 、
、
14.
HCl溶液(如上图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl―)>c(OH―)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl―)=c(OH-)=c(H+)
C.若
D.在D点:
三.填空
15.(10分)(1)部分短周期元素的原子半径及常见化合价如下表:
元素代号
M
Q
R
T
X
原子半径/nm
0.160
0.143
0.099
0.074
0.102
常见化合价
+2
+3
-1
-2
+6,-2
① R元素的阴离子结构示意图为________________。
② 探究M和Q两种元素金属性强弱的实验方法是________________________________。
③ 工业生产中排放的SO2用饱和Na2XO3溶液吸收可化害为利生产化工原料,该反应的化学方程式为____________________________________________________。
若将金属Q的硫酸盐溶液滴加到饱和Na2XO3溶液中,观察到的现象有 _______________。(2)几种常见弱酸的电离平衡常数(
酸
电离方程式
电离平衡常数K
CH3COOH
CH3COOH CH3COO―+H+
CH3COO―+H+
1.76×10-5
H2CO3
H2CO3 H++HCO3―
H++HCO3―
HCO3― H++CO32―
H++CO32―
K1=4.31×10-7
K2=5.61×10-11
H3PO4
H3PO4 H++H2PO4? ―
H++H2PO4? ―
H2PO4? H++HPO42?
H++HPO42?
HPO42? H++PO43―
H++PO43―
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
① 若把HCO3-、H2PO4-、HPO42-都看作是酸,则它们的酸性由强到弱的顺序是____________________________________________________。
② 物质的量浓度相同时,Na3PO4溶液的碱性比Na2CO3溶液_______(强 / 弱)。
16.(11分)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
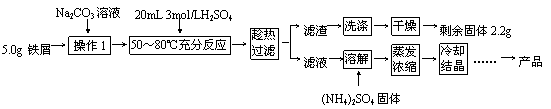 |
回答下列问题:
(1)操作1中Na2CO3溶液作用是______________。用离子方程式表示原理
(2)判断铁屑与硫酸基本反应完全的现象是_________________________________。
(3)某同学认为铁屑与硫酸反应不需精确温度,因此不使用热水浴加热,改用酒精灯断断续续加热维持温度,该做法的不妥之处是___________________________________。
(4)“趁热过滤”后的滤液有时略显黄色,分析其原因是(用离子方程式表示)_______________________________________。
(5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为_______g。
(6)若上述流程用于大量生产,“冷却结晶”后的母液最佳处理方法是_____________。
17.(11分)某探究小组用KMnO4酸性溶液与H
(1)该反应的离子方程式为(提示:H
__________________________________________________________________。
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1, 催化剂的用量可选择
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度 / mol?L-1
溶液褪色所需时间 t / min
第1次
第2次
第3次
0.01
14
13
11
0.001
6
7
7
① 计算用0.001 mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程)。
② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:___________________________________________________。
18.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
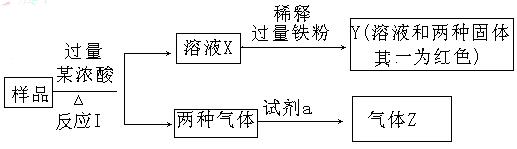
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填化学式)________________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是______________________________。
②若Z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是________________。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________________。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________________。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)__________________________。
19.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO (g) +H2 (g) △H= +131.3 kJ•mol-1
CO (g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
 (3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号
c(H2O)/mol?L-1
c(CO)/mol?L-1
c(H2)/mol?L-1
ν正、ν逆比较
I
0.06
0.60
0.10
ν正=ν逆
Ⅱ
0.12
0.20
________
ν正=ν逆
Ⅲ
0.10
0.20
0.40
ν正____ν逆
(5)己知:
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ?mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ?mo1-1
若将
20.(10分)已知A为常见金属,常温下X、E、F为气体,C为液体。B是一种盐,受热易分解,冷却时分解产物又能化合生成B,B在工农业生产中有着广泛的用途。有关物质之间的转化关系如下图(其中有些反应的条件及部分生成物被略去):

请回答下列问题:
(1)写出物质B的电子式 ;
(2)比较①~⑦七个反应,请归纳它们的共同特点是 ;
(3)写出反应⑦的化学方程式 ;
(4)写出过量A与H浓溶液反应的离子方程式 ;
(5)D是实验中常用的物质,检验D是否变质的方法是:
。
|