
3.等效平衡的判断
化学平衡状态的建立与条件(如浓度、温度、压强)有关,与途径无关。建立平衡状态通常有4条途径:①正向建立;②逆向建立;③从中间某状态建立;④反应物分批加入。对不同的起始状态,通常假定反应沿某一方向进行到底,将所得物质的量与标准状态比较,规律如下:
(1)反应前后气体体积之和不等的可逆反应,如2SO2+O2 2SO3,恒温、恒容投料相同,或恒温、恒压投料成比例,即为等效平衡。
2SO3,恒温、恒容投料相同,或恒温、恒压投料成比例,即为等效平衡。
(2)反应前后气体体积之和相等的可逆反应,如2HI(g) I2(g)+H2(g),恒温、恒容,或恒温、恒压,两种情况均是投料成比例,即为等效平衡。
I2(g)+H2(g),恒温、恒容,或恒温、恒压,两种情况均是投料成比例,即为等效平衡。
2.化学平衡状态的判断
化学平衡状态的标志:v正=v逆;平衡混合物中各组成成分的含量保持不变。“v正=v逆”是化学平衡的本质特征,其含意是反应体系中同一物质的消耗速率和生成速率相等。而各组分的含量“不变”,是指各组分的浓度、质量分数、体积分数(有气体参加的可逆反应)、反应物的转化率等均保持不变。不变不能理解为相等。
判断某一可逆反应是否达到平衡状态的“等价标志”:
(1)对于反应前后气体体积不等的反应,当恒温、恒容时,压强不变、气体的平均相对分子质量不变,或恒温、恒压时,体积不变、混合气体的密度不变,说明反应处于平衡状态。
(2)对于有颜色物质参加的反应,体系颜色不变,说明反应处于平衡状态。
(3)对于吸热或放热反应,绝热体系的温度不变,说明反应处于平衡状态。
1.化学反应速率和化学平衡的内在联系
(1)化学平衡状态产生的根本原因是可逆反应的正反应速率和逆反应速率最终必然趋于相等,从而使反应混合物中各组分的含量保持不变,因此要从“速率”去认识化学平衡的本质。
(2)化学平衡移动的本质原因是正逆反应速率不相等,当v正>v逆,平衡向正反应方向移动,移动的结果是v′正=v′逆;当v逆>v正时,平衡向逆反应方向移动,移动的结果是v′正=v′逆。若条件改变不引起速率变化,则平衡不移动。
(3)化学平衡状态的特点
具有“逆、动、等、定、变、同”六个特点。
①逆:指化学平衡状态只适用于可逆反应,也就是说,只有可逆反应才有正、逆反应,也只有可逆反应在一定条件下才能形成平衡状态。
②动:指动态平衡,即化学反应处于平衡状态时,正、逆反应并未停止,仍在进行,只是速率相等,体现了“静中有动,动中有静”的哲理。
③等:指“v正=v逆≠0”。即某一物质在单位时间内消耗的物质的量浓度和生成的物质的量浓度相等。也可以用不同物质的速率表示该反应的正、逆反应速率相等。
④定:指反应混合物里各成分的含量保持不变,包含内容有:各物质的物质的量或摩尔分数保持一定;各物质的质量或质量分数保持一定。如果是气体物质,则各气体的体积或体积分数保持一定。
⑤变:指平衡移动。可逆反应的平衡状态是相对,暂时的,当外界某一条件改变时,原平衡被破坏,化学平衡向着削弱这种条件改变的方向移动,在新的条件下达到新的平衡状态。
⑥同:指对于同一可逆反应,在同一条件下,无论反应从正反应开始还是从逆反应开始,或正、逆反应同时开始,以一定的配比投入反应物或生成物,则可以达到相同的平衡状态,即各物质的含量相同,称之为“等效平衡”。
25.答案:气体体积缩小,溶液呈浅黄绿色 气体体积进一步缩小,气体和溶液均变成无色
氯水中的平衡:Cl2+H2O HCl+HClO,由于HClO逐渐分解(HClO===HCl+
HCl+HClO,由于HClO逐渐分解(HClO===HCl+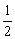 O2)而不断地向右移动,最终Cl2耗尽,全部转化为O2,导致气体体积缩小和黄绿色消褪
O2)而不断地向右移动,最终Cl2耗尽,全部转化为O2,导致气体体积缩小和黄绿色消褪
●命题趋向与应试策略
24.答案:(1)2 1 3 2 (2)气态 固态或纯液体 气体 (3)放热
解析:(1)由可逆反应:
aA + bB  cC + dD
cC + dD
n初 m m m m
n反应 n 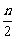
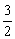 n n
n n
因参加反应的物质的量等于其物质方程式中的化学计量数之比,所以得:a∶b∶c∶d=n∶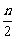 ∶
∶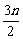 ∶n=2∶1∶3∶2
∶n=2∶1∶3∶2
?即得:a=2,b=1,c=3,d=2?
(2)改变压强,反应速率发生变化,说明反应体系中有气态物质;而平衡不移动说明反应前后气态物质的体积相同V前=V后,即当A为气体,B为固或液,C为固体(题设条件),D为气体时合理。
(3)升温后四种物质的物质的量又达到相等,说明平衡逆向移动,即升温平衡逆向移动,而由勒夏特列原理知升温平衡向吸热方向移动,即逆反应方向吸热,所以其正反应方向为放热。
23.答案:(1)S+O2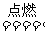 SO2,SO2+CaO
SO2,SO2+CaO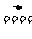 CaSO3,2CaSO3+O2
CaSO3,2CaSO3+O2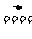 2CaSO4
2CaSO4
(2)加入液NH3平衡NH3+HClO H2O+NH2Cl正向移动,使HClO以NH2Cl形式较稳定存在(NH2Cl比HClO稳定,可较长时间保存)。当需要HClO时(即消耗HClO),平衡左移,又产生HClO起杀菌作用
H2O+NH2Cl正向移动,使HClO以NH2Cl形式较稳定存在(NH2Cl比HClO稳定,可较长时间保存)。当需要HClO时(即消耗HClO),平衡左移,又产生HClO起杀菌作用
解析:(1)此反应不要停留在CaSO3一步。因在此条件下CaSO3必然要被空气中的O2氧化。
(2)HClO不稳定,转化为HClO的盐或NH2Cl后较稳定。
22.答案:(1)正反应 7.0 (2)不相等 两种情况是在两个不同温度下建立的化学平衡,平衡状态不同,所以物质的量也不相同(不从温度角度说明不得分)
解析:此题是一个等压、不等温的过程,且左侧是一个参照条件。
(1)左侧是分子数不变的反应。按题意共有气体12 mol。而右侧当x=4.5时,起始共有气体6.5 mol+4.5 mol+2 mol=13 mol>12 mol因此要保持隔板位于中间,只能向正向反应(因正向是体积数减少的方向)使最后总分子数也为12 mol。
若起始维持这个方向,应有6.5 mol+2 mol+x mol>12 mol,即x>3.5 。由此得出x的最小值。最大值只能从达到平衡时右侧总体积必为12 mol 来求解。
设平衡时,D物质消耗a mol。
D + 2E  2F
2F
n初 6.5 mol x mol 2 mol
n转 a mol 2a mol? 2a mol
n平 (6.5-a) mol (x-2a) mol (2+2a) mol
因x-2a>0,(6.5-a)+(x-2a)+(2+2a)=12
解得x<7.0?
(2)一定注意题中“x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置”。而当x=4.5或5.0时,达到平衡的温度一定不同;而平衡条件不同,平衡时A的物质的量一定不同。
20.答案:(1)H2和H2O,或CO和CO2
(2)2-2a-b
解析:(1)在同一反应容器连续发生了两个反应。只有H2O(g)分解了,CO才能被O2氧化。两反应相互制约,同时达到平衡。但第一反应中H2O和H2与第二个反应无关,同样第二个反应中CO和CO2的浓度与第一个反应无关。(2)从原子守恒角度分析,由CO生成CO2分子内增加的氧原子来源H2O,另外O2中的氧也来源于H2O。因此,n(H2O)反应=2n(O2)+n(CO2)=(2a+b) mol。所以n(H2O)平=[2-(2a+b)] mol。
19.答案:A
解析:达平衡时,容器体积为V L,所以C为0.1 V L,A、B共(V-0.1
V) L=0.9V L,根据平衡方程:
A+3B 2C,反应体积比:1∶3∶2
2C,反应体积比:1∶3∶2
反应体积:0.05V L 0.15V L 0.1V L
A、B反应消耗:0.05V L+0.15V L=0.2V L
原混合气体体积为:0.2V L+0.9V L=1.1V L,所以选A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com