
4.C
3.D (“防患于未然”与后面语义重复。 “不折不扣”,表示完全的、十足的,在A句中修饰“流水线”,使用正确。“气势磅礴”是形容人或事物表现出的力量,气势雄伟、盛大,用在B句,符合语境。“恨铁不成钢”意为“恨某人不争气、不成材。多用于对学生或子女,有时也用于对下属或公众人物”,C句中是把《新剧本》当作师长来看的,因而“恨铁不成钢”使用正确。)
2.A.( ① 放达:言行不受世俗礼法的拘束;旷达:心胸开阔,想得开。② 互动:共同参与,互相推动;互补:互相补充,此意已包含在前面“互涵”之中了。③ 吞噬:吞吃掉,比喻夺取生命;吞蚀:侵吞,侵蚀。 ④ 根据前后语意,前空用转折“但”,强调转折后的语意;后空用“才”,因为两句之间隐含着必要条件关系,而非充分条件关系。)
1.C.(A.踽踽jǔjǔ B.伺sì 戳-戮 D.纹-文 根-跟)
一个七月的黄昏 ① 一抹淡淡的忧伤
暮色镀亮弯弯的荷塘 ② 黄昏的衣裳
温婉的女子依窗 ③ 从指间划过的是
低低吟唱 ④ 一抹淡淡的残阳
西阁楼上慵懒的书卷 和 ⑤ 时光的泪痕呀 沾湿了
一抹淡淡的残阳 ⑥ 从指间划过
A.④②⑥③⑤① B.⑥③④⑤②① C.④⑥③①⑤② D.⑥③①⑤②④
5.下列各句中,没有语病的一项是( )
A.著名清代诗人袁枚来岳麓山游赏,据唐人杜牧《山行》中“停车坐爱枫林晚,霜叶红于二月花”的诗句,将“爱枫亭”之名改成了“爱晚亭”。
B.新的环境伦理则在更理性的层面上告诉人们,乡土野草是值得尊重和爱惜的,它们对于人类和非人类的价值绝不亚于红皮书上的一类或二类保护植物。
C.今年9月10日起,又一批方便民众、还政于民特色的行政法规开始实施,得到了众多媒体的一致好评。
D.开篇就写忧国忧民者,敢称自己是“中国的托尔斯泰”;下笔爱写个现代诗的,则欣然以“东方泰戈尔”自居:这些初出茅庐的青年作者可真是大言不惭啊!
3.常见配平方法
(1)化合价升降法(即电子得失法或氧化数法)
这类方法既可以配平分子反应式,也可以配平离子反应式,它是氧化还原反应的一般配平方法。化合价升降法的配平步骤是:
①写出反应物和生成物的化学式,分别标出变价元素的化合价,得出升降数目。
②使化合价升高与化合价降低的总数相等(求最小公倍数法)。
③用观察的方法配平其它物质的化学计算数(包括部分未被氧化或还原的原子(原子团)数通过观察法增加到有关还原剂或氧化剂的化学计量数上),配平后把单线改成等号。
该基本步骤可简记作:划好价、列变化、求总数、配化学计量数。
例3.由硫可制得多硫化钠Na2Sx,x值一般为2-6,已知Na2Sx与NaClO反应的化学方程式如下:
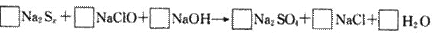
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_____________。
解析:本题解答的关键必须正确标出Na2Sx中硫的氧化数(化合价),由化合物中化合价的代数和等于零这一原则得硫的氧化数为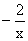 。分析反应前后元素的化合价变化情况,硫元素由
。分析反应前后元素的化合价变化情况,硫元素由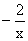 升高到十6价,每个硫原子净升高数为
升高到十6价,每个硫原子净升高数为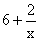 ,x个硫原子共升高6x十2,NaClO中氯元素的化合价由十1价降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x十1。
,x个硫原子共升高6x十2,NaClO中氯元素的化合价由十1价降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x十1。 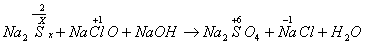 其他物质前面的系数使用观察法配平。根据NaClO和NaOH的物质的量之比为2:1有:(3x十1)/(2x-2)=2,算出x=5。
其他物质前面的系数使用观察法配平。根据NaClO和NaOH的物质的量之比为2:1有:(3x十1)/(2x-2)=2,算出x=5。
答案: 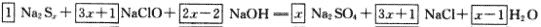 多硫化钠的化学式为Na2S5。
多硫化钠的化学式为Na2S5。
例4. 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg·L-1现用氯氧化法处理,发现如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是_________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+Cl2 →C02+ N2+______KCl+ ______ H2O
解析: (1)在反应KCN+2KOH+C12→KOCN+2KCl+ H20中,碳元素的化合价从+2上升到+4,失电子被氧化。 (2)从:KCN+KOH+C12→CO2+N2+KCl+ H20可知,N、C两元素的化合价从-3、-2分别升至0、+4,而C1元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得2KCN+4KOH+3C12→2C02+N2 +6KCl+2H20
答案:(1)碳(或C);(2)2;4、3、2、1、6、2
(2)离子-电子法(半反应法)
此方法是将反应式改写为氧化和还原两个半反应,先将半反应配平,然后将这些半反应加合起来,消去其中的电子,便完成了配平.此类方法比较适用于某些化合物中元素的氧化数比较难于确定的反应方程式,适用于溶液中的氧化还原反应的配平。
例5.配平MnO4-+ C3H7OH→Mn2++C2H5COOH(酸性介质)
解析:任何一个氧化还原反应都是由两个半反应组成的。因此可以将这个方程式分成两个未配平的半反应式,一个代表氧化,一个代表还原。对于此反应可以写成:
MnO4-→Mn2+(还原) C3H7OH→C2H5COOH(氧化)。由于反应在酸性介质中进行,加H+和H2O配平半反应式两端的氢原子数,并使两端电荷数相等:
MnO4-+8H++5e--=Mn2++4H2O①
C3H7OH+H2O= C2H5COOH+4H++4e-②
根据得失电子数必须相等,将两边电子消去,加合成一个已配平的反应式。
①×4+②×5得:4MnO4-+12H++5C3H7OH =4Mn2++5C2H5COOH+11H2O
经检验:配平正确。
(3)自身氧化还原反应方程式的逆向配平法
自身氧化--还原反应是电子转移发生于同一种物质的同一种元素间或同一种物质分子内部不同种元素间的氧化--还原反应。从化学反应方程式的生成物一侧入手,从右向左进行配平。
例如:配平Cl2+KOH--KCl+KClO3+H2O
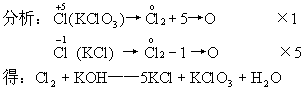
KCl和KClO3系数之和除2,就是Cl2的系数,其余系数再通过观察确定。
即:3Cl2+6KOH  5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
说明:在化合价升降法的基础上采用逆向配平的方法。有助于培养辩证思维,是对传统方法的创新。
2.配平的思路
一般分两部分:第一部分是氧化剂、还原剂、氧化产物、还原产物之间的配平-化合价升降相等或电子得失数相等;第二部分是用观察法配平其他物质的化学计量数。
1.配平的原则
(1)电子守恒:氧化还原反应过程中,氧化剂得电子总数目等于还原剂失电子总数目,即:“电子得失数相等”“化合价升降数相等”。
(2)质量守恒:反应前后各元素的原子个数相等。
(3)电荷守恒:对于离子方程式,等式两边“电荷总数相等”。
原理是:氧化剂得到的电子总数等于还原剂失去的电子总数。
例2.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1:3 B.2:3 C.1:1 D.4:3
解析:首先判断氧化产物是氮气,还原产物是二氧化硫。每生成1摩尔氮气需要失去6摩尔电子,每生成1摩尔二氧化硫需要得到2摩尔电子。根据得失电子相等的原理,氧化产物和还原产物的物质的之比应为1:3。
答案:A
说明:解这类题目不必都写出完整并配平的氧化还原反应方程式,关键是抓住本质,厘清得失相等的关系。
2.常用判断方法
(1)依据元素在同期表的位置判断
从左到右:金属单质的还原性依次减弱,非金属单质的氧化性逐渐加强。
从上到下:金属单质的还原性依次增强,非金属单质的氧化性逐渐减弱。
单质氧化性:F2>Cl2>Br2>I2>S
离子还原性:S2_>I->Br->Cl->F-
单质还原性:Na>Mg>Al
离子氧化性:Al3+>Mg2+>Na+
(2)根据金属的活动性顺序表来判断

(3)通过氧化还原反应比较:氧化剂+还原剂 氧化产物+还原产物
氧化产物+还原产物
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(4)通过与同一物质反应的产物比较:如:2Fe+3Cl2 ======2FeCl3 ,Fe+S======FeS ,可得出氧化性Cl2 >S。
(5)反应原理相似的不同反应中,反应条件要求越低,说明氧化剂或还原剂越强。
如卤素单质与H2的反应,按F2、Cl2、Br2、I2的顺序反应越来越难,反应条件要求越来越高,则可得出氧化性F2>Cl2 >Br2 >I2 。
(6)对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe;价态越低,氧化性越弱,如S2―<S<SO2。(特例:氧化性HClO>HClO2>HClO3>HClO4 )
(7)据原电池电极:负极金属比正极金属活泼(还原性强);据电解池中放电顺序,先得(或失)电子者氧化性(或还原性)强,其规律为:阳离子得电子顺序(即氧化性强弱顺序):参考②中规律。阴离子失电子顺序(即还原性强弱顺序):S2->I->Br->Cl->OH->NO3- 、SO42-等。
说明:氧化性与还原性受外界因素的影响。
温度:温度高时,氧化剂的氧化性和还原剂的还原性均增强。如浓H2SO4具有强氧化性,热的浓H2SO4比冷的浓H2SO4氧化性要强。
浓度:浓度大时,氧化剂的氧化性和还原剂的还原性均增强。如浓H2SO4具有强氧化性,稀硫酸只有H+显示弱氧化性。
酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。在酸性环境中,KMnO4的还原产物为Mn2+;在中性环境中,KMnO4的还原产物为MnO2;在碱性环境中,KMnO4的还原产物为K2MnO4 。在使用高锰酸钾作为氧化剂检验或除杂一些还原性物质时,为了现象明显,反应快速。往往使用酸性高锰酸钾溶液。
例1.常温下,在下列溶液中发生如下反应: ①16H+十10Z-十2XO4-=2x2+十5Z2十8H2O ②2A2++B2=2A3+十2B- ③2B-十Z2=B2十2Z- 由此判断下列说法错误的是( ) A.反应Z2十2A2+=2A3+十2Z-可以进行 B.Z元素在①③反应中均被还原 C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+ 解析:根据规律,在同一反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,得出:氧化性XO4->Z2>B2>A3+,还原性A2+>B->Z->X2+。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com