
4、等效平衡原理及判定
一定条件下进行的 反应,不论从 开始,还是从 开始,或者 反应同时开始,都可以建立 的平衡状态,这就是等效平衡的原理。
⑴恒温、恒容
①若气体前后计量数之和不等,只要极限转换后,与 的物质的量(或浓度) ,就可以达到相同平衡状态。②若气体前后计量数之和相等,极限转换后,与 的物质的量之比 就可以达到相同平衡状态。
⑵恒温、恒压
只要极限转换后,与 的物质的量之比 就可以达到相同平衡状态。
3、特征:
2、研究对象:
1、概念:
4、影响化学反应速率的因素:
内因:
外因: 、 、 、 等。
3、用不同物质表示同一反应的速率时,速率的比值 化学方程式中相应的化学计量数之比。
2、表示方法:
。
公式:v = 单位:
1、概念:化学反应速率是用来衡量化学反应进行快慢程度的物理量。
3.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
[例1] 下图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指

①N2(g)+3H2(g)  2NH3(g);△H=-Q
2NH3(g);△H=-Q
②H2(g)+I2(g)  2HI(g);
△H=+Q
2HI(g);
△H=+Q
③CO(g)+2H2(g) CH3OH(g);
△H=-Q
CH3OH(g);
△H=-Q
④2SO3(g)2 2SO2(g)+O2(g);
△H=+Q
2SO2(g)+O2(g);
△H=+Q
A.平衡混合气中一种生成物的百分含量
B.平衡混合气中一种反应物的百分含量
C.平衡混合气中一种生成物的转化率
D.平衡混合气中一种反应物的转化率
[解析] 该题要求能够运用勒沙特列原理迅速逆向思维,当压强增大时,①③的平衡均右移,而Ⅰ曲线为增大趋势,(A)、(D)符合题意;②所对应的Ⅱ曲线无变化,平衡不移动故与该题的解无关;④在增大压强时平衡逆向移动,Ⅲ曲线为减小趋势,(A)、(D)符合题意。所以,答案为AD。
[例2] 由可逆反应测绘出图象如下图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是
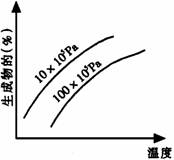
A.反应物中一定有气体 B.生成物中一定有气体
C.正反应一定是放热反应 D.正反应一定是吸热反应
[解析] 定一议二。温度不变时,增大压强,生成物的百分含量降低,说明平衡逆向移动,逆向为体积缩小方向,而题中未给出具体的可逆反应,但是可以确定生成物中一定有气体;压强不变时,升高温度,生成物的百分含量增大,说明平衡正向移动,正向为吸热反应;所以答案为BD。
基础知识
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com