
3.溶液各种浓度的计算
(1)物质的量浓度与质量分数的换算公式:
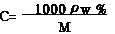
(2)物质的量浓度与溶解度的换算公式:
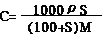
(3)不同物质的量浓度溶液的混合计算
① 稀释定律:C1V1=C2V2或m1W1=m2W2
②混合后溶液体积不变
C1V1+C2V2=C混(V1+V2)
③混合后溶液体积改变
C1V1+C2V2=C混V混
V混=m混/ρ混
(4)标准状况下求气体溶解于水中所得溶液的物质的量浓度的计算
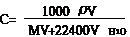
例6: 在标准状况下,1体积的水溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,则该溶液的物质的量浓度为(水密度为1 g/cm3) ( )
A.18.4 mol·L-1 B.20.4 mol·L-1 C.31.25 mol·L-1 D.33.1 mol·L-1
解析:正确答案选A。水的体积和氨气的体积必须单位相同,如果以“L”为单位,则分别求出溶质的物质的量和溶液的体积,溶液物质的量浓度为18.4 mol·L-1。
例7:体积为VmL,密度为dg/cm3的溶液,含有式量为M的溶质mg,其浓度为C mol·L-1,质量分数为w%,下列表示式中正确的是( )
A.c=(w×100×d)/M
B.m=V×d×
C.w%=(c×M)/(1000×d)%
D.c=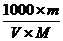
解析: 正确答案为B、D。
对A应为:c=(w%×1000×d)/M=(w×10×d)/M;对B溶质的质量为:m(溶质)=m(溶液)×ρ=(v×d)×w%;对C取1L溶液溶质的质量分数为:w%=[(c×M)/1000×d]×100%=[(c×M)/10×d]%;对D: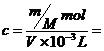
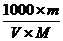 mol·L-1。
mol·L-1。
2.有关离子浓度的计算,注意利用电荷守恒原理
例3:硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol·L-1,硫酸根离子浓度为0.7 mol·L-1,则K+的物质的量浓度为( )
A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.3 mol·L-1 D.0.2 mol·L-1
解析:正确答案选D。假设烧瓶的容积为1L,则根据电荷守恒3nAl3++ nK+=2 nSO42-,得
K+的物质的量浓度为0.2 mol·L-1。
1.有关概念的计算:利用“万能恒等式”
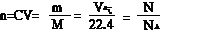
例2:在标准状况下,用充满HCl气体的烧瓶做喷泉实验,最终水充满烧瓶,则盐酸的物质的量浓度为( )
A.0.05 mol·L-1 B.0.01 mol·L-1 C.0.045 mol·L-1 D.无法计算
解析:正确答案选C。假设烧瓶的容积为V升,则HCl气体的体积为V升,最后所得盐酸溶液的体积也为V升,所以: cHCl=
cHCl=
2.配制步骤
(1)计算:根据配制要求计算出所需固体溶质的质量或所需浓溶液的体积
(2)称量:用托盘天平称量固体溶质的质量或用量筒量取溶质的体积
(3)溶解:将称量或量取的溶质放入烧杯中再加入适量的蒸馏水,用玻璃棒搅拌使之溶解。
(4)转移:将溶解的溶液冷却至室温,沿玻璃棒注入准备好的容量瓶里,并用适量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将洗涤液转移至容量瓶中。
(5)定容:往容量瓶中继续缓慢地加入蒸馏水至距刻度1-2cm处,改用胶头滴管逐滴加入蒸馏水直到凹液面最低点与刻度线水平相切,盖好容量瓶塞,颠倒摇匀,然后将配好的溶液装入干净试剂瓶中,贴上标签,注明名称、浓度、配制日期。
原理:cB = nB/V=m/MV(M-溶质的摩尔质量,配制某种溶液时是定值)
(1)称量或量取时所引起的误差
使所配溶液的物质的量浓度偏高的主要原因:
①天平的砝码沾有其他物质或已锈蚀,导致称量物质的实际值是大于称量值;
②称量时游码忘记归零;
③调整天平零点时,游码放在了刻度线的右端;
④用滴定管量取液体时,开始时平视读数,结束时俯视读数,使所量取的液体的体积偏大,等等。
使所配溶液的物质的量浓度偏低的主要原因:
①直接称热的物质,含有水份,称的重,实际质量却小;
②砝码有残缺;
③在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时的动作过慢而变质;
④用滴定管量取液体时,开始时平视读数,结束时仰视读数,使所量取的液体的体积偏小,等等。
(2)用于溶解稀释溶液的烧杯未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液的浓度偏低。
(3)转移或搅拌溶液时有部分液体溅出,致使溶液浓度偏低。
(4)容量瓶内溶液的温度高于20℃,造成所量取的溶液的体积小于容量瓶上所标注的液体的体积,致使溶液浓度偏高。
(5)在给容量瓶定容时,仰视读数会使溶液的体积增大,致使溶液浓度偏低;俯视读数会使溶液的体积减小,致使溶液浓度偏高。
例1:利用硫酸铜晶体(CuSO4·5H2O)配制0.2 mol/L的CuSO4溶液500mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏低的是( )
A.定容时,俯视观察刻度线
B.称取25g的硫酸铜晶体
C.定容后摇匀,静置时发现液面低于刻度线,于是又加水至刻度线
D.移液时,不小心将一滴液体溅出容量瓶。
解析:正确答案选CD。A项中俯视时液面的最低点低于刻度线,使得溶液的体积偏低,导致浓度偏高;B项是正确操作,不会影响浓度;C项摇匀后低于刻度线是由于液体沾在瓶壁和磨口处所致,不会引起误差,若加水则使浓度偏低;D项由于溅出液体,使得溶质的物质的量偏小,导致浓度偏低。
1. 所需实验仪器
托盘天平、钥匙、烧杯、玻璃棒、容量瓶、胶头滴管,若溶质为液体或浓溶液,上述仪器中的托盘天平、钥匙改为量筒。
4.在一定浓度的溶液里取出任意体积的溶液,其浓度大小不变,所含溶质的质量改变。
3.V是溶液体积,不是溶剂体积。
2.带有结晶水的物质作为“溶质”时,溶质是不含结晶水的化合物;NH3、Cl2等溶于水后成分复杂,求算浓度时仍以溶解前的NH3、Cl2为溶质。
以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
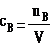
表达式:
单位:mol·L-1或mol·m -3
注意:
1.溶质可以是单质、化合物,如C(Cl2)=0.1mol·L-1,C(NaCl)=3.1mol·L-1;也可以是离子或其他特定组合,如C(Al3+)=2.6mol·L-1,C(SO42-)=0.3mol·L-1。
|
|
甲烷 |
乙烯 |
乙炔 |
|
药品 |
|
|
|
|
反应 |
|
|
|
|
装置 |
|
|
|
|
除杂 |
|
|
|
|
干燥 |
|
|
|
|
收集 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com