
1、写出下列有关物质化学式:丙_________;B _________。
1.煅烧石灰石 2.煅烧黄铁矿 3.二氧化硫的催化氧化 4.氨的催化氧化 5.合成氨 6.电解饱和食盐水 7.工业制盐酸 8.高炉炼铁 9.工业制取漂粉精 10.工业制水煤气 11.硅酸盐工业等。
例题8 (2005年江苏高考化学试题)下图中,A、C是工业上上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
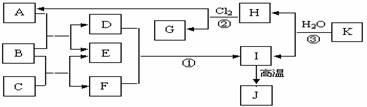
请按要求回答:
⑴ 写出B的化学式 ,G的电子式 。⑵ 反应①的离子方程式为 ;
⑶ 反应②进行的条件是 ;⑷ 反应③的化学方程式为 。
解析:由H、G是正四面体结构的非极性分子,H是一种重要的能源,又结合H+CI2→A+G,可确定H为CH4,G为CCI 4,则A为HCI。日常生活中常见的金属主要有Fe、AI等,再结合化学课本上介绍过的一种耐高温材料AI2O3,可大胆推测B可能是AI。把AI带入框图分析,便可逐一推出其他物质。故G(CCI 4)的电子式为 ,反应①的离子方程式为Al3+ +3AlO2-+6H2O ==4Al(OH)3↓,反应②进行的条件是光照、过量Cl2,反应③的化学方程式为Al4C3+12H2O ==4Al(OH)3+3CH4↑
,反应①的离子方程式为Al3+ +3AlO2-+6H2O ==4Al(OH)3↓,反应②进行的条件是光照、过量Cl2,反应③的化学方程式为Al4C3+12H2O ==4Al(OH)3+3CH4↑
(6)解题突破口是“特征数据”
反应物物质的量比、相对分子质量、化合物中离子个数比、电子总数、化合价等
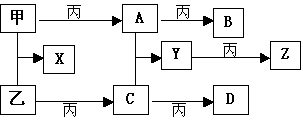
例题9 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见的化合物,Y的摩尔质量数值比Z的小16,乙、丙的摩尔质量相同,B的摩尔质量比D的小2,B、X的摩尔质量相同,各物质转化关系如下:
3.2F2+2H2O=4HF+O2
4.2Mg+CO2  2MgO+C
2MgO+C
(5)解题突破口是“重要工业生产反应”
中学重要工业生产反应
1.3Fe+4H2O(气) Fe3O4+4H2↑ 2.CO+H2O(气)
Fe3O4+4H2↑ 2.CO+H2O(气) CO2+H2
CO2+H2
4.写出一个F作为氧化剂的方程式:____________________
[命题意图]本题以高温时的常见反应为载体,考查的是高温时铁与水的反应,CO与水的的反应,氧化物被H2的还原。既考了高中的主干知识,又考了科内知识综合,还考了综合的推理判断能力。
[解题思路]本题题干和框图都很模糊,根本得不出什么结论。但如果熟悉高温下常见反应,就可以此为突破口,再根据A是常见金属单质、B是最常见溶剂,就可以得出相应的答案。
[正确答案]
3.写出一个B作为还原剂的方程式:___________________
2.写出③化学方程式:______________________________
1.写出①化学方程式:__________________________
2、当X是强酸时,E是 ______ ; 当X是强碱时,E是 ______。
[命题意图]考查一种物质能与酸与碱作用产生气体,考氮与硫等元素化合物的知识,以及推理、综合运用知识的能力。
[解题思路]突破口是:a.当X无论是强酸或强碱都有如下反应关系 b.B、C、D中间两次与Y作用特殊关系,再利用其他已知就容易解了。
[正确答案]1.(NH4)2S;O2;H2O 2.H2SO4 ;HNO3
(4)解题突破口是“特殊反应条件”

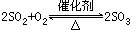

(a)高温:铝热反应,制玻璃,烧石灰,炼铁,制水煤气,制粗硅,水与Fe反应等。

(b)高温高压、催化剂
(c)加热、催化剂
(d)放电 
 等等。
等等。
例题7 物质A-F有如下转化关系,反应均是高温下进行,(必要时要用催化剂)A是常见金属单质,B是最常见溶剂,E分子与N2电子数相同。
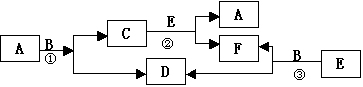
1、A是______,Y是______ ,Z是______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com