
3.能识别和绘制典型的实验仪器装置图
识别典型实验装置和绘制其简图,也是从事化学实验的一种必备的能力。在高考化学实 验题中识图的试题也是很多的,主要是有图示实验,由图来说明某具体实验;对一些基本操作或实验装置图判断正误,或将错误部分改正;对所给的单个仪器、导管、或者几个小装置的识别,然后加以组装,连接成大装置图。绘图的试题目前还不多,主要是绘制很典型的实验装置简图,或是在题中所给的位置补绘一些仪器简图。所有这些试题都要求学生熟悉常见 仪器和典型实验的装置图,并掌握一定的绘制简图的方法。
2.根据实验试题要来,设计基本实验方案
近些年来高考化学实验题中,设计简单实验方案的试题较多。其中有某个实验操作顺序 的设计,也有设计确定某混合气中组分的实验;有验证某个化学原理的设计实验,也有设计某物质纯度的测定实验;有定性实验的设计,也有定量实验的设计……从题型上看,有简答 题、填充题,也有两者兼有的混合题。这些简单实验的试题,大都思考性、综合性较强,考生必须细心、冷静地审题,联系所学过的实验知识和技能技巧,进行知识迁移、联想、重组,全面而细致地思考,才能设计出正确的方案或回答试题中的问题。
掌握化学实验的记录方法和运用化学知识设计一些基本实验。
1.根据实验现象,观察、记录、分析或处理数据,得出正确结论
在高考化学实验试题中,实验现象的考查可以是直接考实验现象,也可由现象得出正确 的结论,还可将有关实验现象与实验方法、正确的结论等联系起来。实验结果的分析,通常是分析实验关系、细节和误差等等。实验结果的处理,可以直接报道数据,也可能是找出相关关系得出公式,或绘制一定的变化曲线等。
3.实验设计内容
概括地讲,设计一个实验通常包括以下几个方面内容:
(1)根据命题要求,说明设计该实验的原理,画出实验装置图。
(2)列出实验操作步骤,说明实验中应注意的事项。
(3)观察、记录实验现象,分析实验结果(包括写出有关的化学方程式),得出正确的结论。
2.实验设计原理
通过对新旧信息的加工开发,实现指定的实验设计。从设计的要求及解决问题的顺序分 析,大致有以下两个层次:一是实验方法的选定。这是从总体上考虑实验方案的设计。一般说来,实验方法主要取决于实验原理,并受实验条件的制约。二是实验装置和实验操作设计。装置和操作都是为了具体实施实验方法,完成实验任务,通常属于实验方案细节的设计。和基本实验方法比较,它们往往更贴近实验的基础知识与基本技能。
化学实验设计题(如高考大实验题)重在培养或考查把已有知识和技能运用于新情景的 能力,它所选择的课题往往是没有直接、系统实践过的。从信息加工角度分析解答时,还要能够从题目中敏捷地接受信息,分析评价信息,选择、调用自己贮存的相关知识,将新信息与已有知识有机地结合起来,以解决实验设计的新问题。大致过程与思路如下:
1.接受信息
接受、分析、筛选信息,明确实验设计的课题、条件和要求。
要求迅速、全面地吸收题目中的新信息,分析提供这些信息的目的,把信息归类、并对各个信息在实现实验设计中的作用做初步评估。
接受信息主要解决以下问题:一是明确实验课题;二是明确实验条件;三是明确设计要 求。
4.推断
推断是通过已知实验事实,根据性质分析推理出的物质的组成、结构或名称。
推断与鉴别、鉴定的区别在于:鉴别、鉴定中的每一步都靠自己设计,可以尽自己的长处选比较熟悉的知识;推断则不然,条件已给出,虽只回答结论,但环上套环,答题者必须根据作者的用意回答问题,往往思考难度大。
试题枚举
[例1] 在实验室运用铜和必要的药品装置制备无水氯化铜,清指出实验程序。
[解析] 铜与氯气在加热时可制得氯化铜,不但考虑制氯气,还得考虑氯气的净化、干燥以及多余氯气的吸收。
[例2] 怎样清除玻璃仪器上粘附的不易溶于水的下列物质?
(1)碳酸盐 (2)氢氧化物[氢氧化亚铁、氢氧化铜等] (3)二氧化锰 (4)硫 (5)银盐 (6)银镜和铜镜 (7)油污
[解析] (1)用稀盐酸。往碳酸盐污迹上满盐酸或用盐酸浸洗。
(2)用稀盐酸。将其溶解转变成可溶性物质后再用水刷。
(3)用浓盐酸。二氧化锰溶于盐酸变成二氯化锰。也可用硫酸亚铁酸性溶液或草酸及盐酸洗液,用硫酸酸化的草酸盐溶液清除。如盛高锰钾溶液的试剂瓶内壁上常粘附有一些棕黄色的二氧化锰污迹,又如实验室用二氧化锰和盐酸制取氯气时,烧瓶内壁上也往往残留有棕褐色的二氧化锰斑点,也常用上述方法清除。
(4)硫迹可加石灰水加热煮沸除去。
(5)银盐污迹可用硫代硫酸钠清除。如:
AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr
(6)银镜和铜镜都可用稀硝酸清除。反应方程式为:
3Ag+4HNO3=3AgNO3+2H2O+NO↑
(7)油污一般可用纯碱、火碱溶液或热肥皂水来清除。
[例3] 怎样取少量液溴于试管中?
[解析] 因为液溴对橡胶有腐蚀作用,故不能用滴管取。应用手按住玻璃管的一端插入液溴层,放开手指让液溴进入玻璃管,再用手指按住玻管口,并将导管移至试管底部,最后极开手指,放出液溴。
[例4] 请你说明给盛溶液的试管加热时应注意如何操作?
[解析] (1)试管外壁应干燥,有水珠应擦干,试管里的液体不应超过试管容积的1/3。
(2)试管应用试管来夹持,不能用手拿着加热以免烫伤手。(试管夹夹持试管的方法是:把试管夹张开,由试管底部套上、取下,不得横套横出)试管夹应夹在离试管口 1/3处。加热时握持试管夹的方法是:右手三指(拇、食、中)握持试管夹长柄。
(3)加热时,应将试管倾斜,以与桌面成对45度角为宜。
(4)加热时,应先使整个试管均匀受热,然后小心地在溶液的中下部加热(不要集中烧试管底部以防溶液喷出),并不断摇动试管,保持试管在灯焰内缓缓转动。
(5)试管底部应位于酒精灯的外焰部分(外焰温度最高),加热时不能使试管底部跟灯芯接触。(因灯芯温度较低,较热的试管底部突然冷却容易炸裂)。
(6)试管口不要对着自己或别人,更不能把眼睛对着正在加热的试管口张望。
[例5] 怎样加热坩埚?
[解析] 加热坩埚时,应把坩埚放在铁圈上或泥三角上,用喷灯加热。取放坩埚时, 应用坩埚钳夹取。要夹取高温的坩埚时,应把坩埚钳尖端在火焰下预热一下或待坩埚稍冷再夹取。不宜用瓷坩埚熔化烧碱、纯碱及氟化物。因为它们可和瓷共熔使坩埚遭腐蚀。
[例6] 请举出水浴加热五例。
[解析] 溶解度测定、酚醛树脂制取、苯的硝化、银镜反应、苯的磺化。
[例7] 请举出实例,为达到分离或提纯固和固、固和液、液和液、气和气物质的目的,而自行采用物理方法或化学方法。
[解析] (1)固和固物质的分离
均溶于水时:如氯化钠和硝酸钾,采用重结晶;再如氯化钠和淀粉,采用渗析法;而氯化钠和氯化钙,则加碳酸钠采用化学方法,之后过滤,沉淀再滴加适量盐酸。
一种物质溶于水时:如氯化钠和沙子,采用过滤方法。
均不溶于水时:如炭和氧化铜采用化学方法,加盐酸溶解氧化铜,过滤、洗涤得炭,滤液滴加氢氧化钠溶液足量,加热溶液,使氢氧化铜全部分解,过滤、洗涤、干燥得氧化铜。再如炭和碘,可直接加热升华后,得炭,蒸气冷却得碘。
(2)固和液物质的分离
不溶的固体和液体:如硫酸钡悬浊液采用过滤方法。
互溶的固体和液体:如碘水采用萃取、分液方法。再如食盐溶液采用蒸发方法。
(3)液和液物质的分离
混溶物:如酒精和水采用蒸馏的方法。
不溶物:如苯和水采用分液方法。
(4)气和气物质的分离和提纯。
若含沸点不太高的气体时,可液化。如氨气和氢气的分离。提纯时一般采用洗气方法。
3.鉴定
鉴定通常是指对于一种物质的定性检验,鉴定是根据物质的化学特性,分别检出阳离子 、阴离子。是根据物质的某些特性,也就是所采用试剂或方法只对此例成立,再者要全证明 。
2.鉴别
鉴别通常是指对两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另 一种物质;也可根据几种物质气味、溶解性、溶解时的热效应等一般性质的不同加以区别。 鉴别题的种类包括:
(1)大范围的鉴别题
一般是通过实验先分组,一直到两个未知物为一组,只要鉴别了其中之一,另一个也就确定了。此类题可任意选用试剂或方法完成之。
(2)只用一种试剂或方法鉴别的题
a.选用焰色反应等操作方法 b.据溶解度、比重等物理方法
c.加一种化学试剂逐一鉴别 d.加一种化学试剂一次性鉴别
e.附加条件加一种化学试剂一次性鉴别 f.加一种试剂少量到多量一次性鉴别
g.加一种试剂同时利用物理方法和化学方法鉴别
h.加酸碱指示剂一次性鉴别
(3)不许用外加试剂鉴别法
①如鉴别的溶液没有特殊的外观特征,采用两两相混,将现象列表据现象不同鉴别之。
②如要鉴别的几种溶液之一有明显的外观特征,可先将其鉴别出,并以它为试剂鉴别出 另一种,再用该种试剂鉴别其它,以此类推。
1.制备
除掌握常见气体和典型有机物的制备方法外。做其它综合制备题时,思路往往是逆向的。几种常见气体的反应原理见下表
|
1 |
O2 |
2KClO3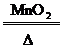 2KCl+3O2↑ 2KMnO4 2KCl+3O2↑ 2KMnO4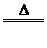 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
|
2 |
NH3 |
2NH4Cl+Ca(OH)2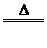 CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O |
|
3 |
CH4 |
CH3COONa+NaOH Na2CO3+CH4↑ Na2CO3+CH4↑ |
|
4 |
H2 |
Zn+H2SO4(稀)=ZnSO4+H2↑ |
|
5 |
CO2 |
CaCO3+2HCl=CaCl2+CO2↑+H2O |
|
6 |
H2S |
FeS+H2SO4(稀)=FeSO4+H2S↑ |
 7 7 |
SO2 |
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 或Cu+2H2SO4(浓) 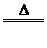 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
|
8 |
NO2 |
Cu+4HNO3(浓)  Cu(NO3)2+2NO2↑+2H2O Cu(NO3)2+2NO2↑+2H2O |
|
9 |
NO |
3Cu+8HNO3(稀)  3Cu(NO3)2+2NO↑+4H2O 3Cu(NO3)2+2NO↑+4H2O |
|
10 |
C2H2 |
CaC2+2H2O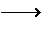 Ca(OH)2+CH≡CH↑ Ca(OH)2+CH≡CH↑ |
|
11 |
Cl2 |
MnO2+4HCl(浓)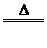 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
|
12 |
HCl |
NaCl(固)+H2SO4(浓) NaHSO4+HCl↑ NaHSO4+HCl↑ |
|
13 |
C2H4 |
C2H5OH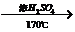 CH2=CH2↑+H2O CH2=CH2↑+H2O |
|
14 |
N2 |
NaNO2+NH4Cl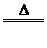 NaCl+N2↑+2H2O NaCl+N2↑+2H2O |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com