
3、质量数、元素的近似相对原子质量
质量数是忽略电子质量,将核素中所有质子相对质量和中子相对质量取近似整数值之和。
实例:相对原子质量为的核素35Cl的质量数为35。
相对原子质量为的核素37Cl的质量数为37。
元素的近似相对原子质量是该元素各种天然同位素原子的质量数与其原子百分比的乘积之和。  实例:(1) Cl元素的两种核素35Cl、37Cl的相对原子质量分别34.969和36.966,则35Cl和37Cl的关系是___同位素___。其质量数分别是__35___、___37___。
实例:(1) Cl元素的两种核素35Cl、37Cl的相对原子质量分别34.969和36.966,则35Cl和37Cl的关系是___同位素___。其质量数分别是__35___、___37___。
(2) 若35Cl和37Cl在自然界的原子百分组成之比是3∶1,则Cl元素的近似相对原子质量为_35_×3/4 + 37×1/4 =35.5___。
2、元素、核素、同位素、同素异形体:
|
|
元素 |
同位素 |
核素 |
同素异形体 |
|
概念 |
具有相同核电荷数的同一类原子的总称 |
质子数相同而中子数不同的用一元素的不同原子互称为同位素(化学性质几乎完全相同,只是某些物理性质略有不同) |
具有一定数目的质子和一定数目的中子的一种原子 |
由同种元素组成的结构和性质不同的单质互称为同素异形体 |
|
例 |
氧(O)元素 氢(H)元素 |
如160、17O、180是氧元素的三种核素,互为同位素 。 。 |
如1H(H)、2H(D)、3H(T)就各为一种核素。 |
O2和O3 红磷和白磷 金刚石和石墨 |

|
|
 中子N(0)
核素、同位素
中子N(0)
核素、同位素

 原子核
原子核
|
|
|
 质子Z(+1)
元素符号
质子Z(+1)
元素符号
原子结构 最外层电子数:
 电子数:
电子数:
核外电子
|
 内层电子数:
内层电子数:



e(-1)
排布规律 :分层排布 周期序数及原子半径
1、原子中存在的两个关系式是:
① 质量关系:质量数A=Z+N
(1个质子质量约为1.673×10-27Kg,1个中子质量约为1.675×10-27Kg,用其分别与12C原子质量的1/12(1.661×10-27Kg)相比而得1个质子和中子相对质量分别为1.007和1.008,1个电子的相对质量约为质子质量的1/1836,所以,原子的质量主要集中在原子核上)
② 电子关系:中性原子的核外电子数=质子数=核电荷数= 原子序数
阳离子的核外电子数=质子数-阳离子所带电荷数
阴离子的核外电子数=质子数 + 阳离子所带电荷数
实例:微粒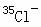 所含质子数__17___;中子数__35-17=18____;电子数_17+1=18___;质量数__35____。
所含质子数__17___;中子数__35-17=18____;电子数_17+1=18___;质量数__35____。
经历了五个发展阶段:
①1803年英国化学家道尔顿家建立了原子学说;
②1903年汤姆逊发现了电子建立了“葡萄干布丁”模型;
③1911年英国物理学家卢瑟福根据α粒子散射实验提出原子结构的核式模型;
④1913年丹麦科学家玻尔建立了核外电子分层排布的原子结构模型;
⑤20世纪20年代建立了现代量子力学模型。
6.核酸
⑴概念:核酸是一类含磷的生物高分子化合物,一般由几千到几十万个原子组成,相对分子质量达十几万至几百万。
⑵分类:
 脱氧核糖核酸(DNA)
脱氧核糖核酸(DNA)
核酸
核糖核酸(RNA)
⒈蛋白质的组成元素有: ,它为天然高分子化合物,水解最终产物为氨基酸,故氨基酸为蛋白质的基石。
⒉氨基酸的组成:分子中同时含有 和 。
常见的几种氨基酸的结构简式:
甘氨酸: ; 丙氨酸: ; 苯丙氨酸: ;
谷氨酸: 。
⒊氨基酸的性质
⑴物理性质
天然的氨基酸均为 晶体,熔点200-300℃,可溶于水,不溶于乙醚。
⑵化学性质:
①两性:
写出甘氨酸与NaOH和HCl反应的化学方程式:
②酯化反应
写出甘氨酸与乙醇酯化的化学方程式:
③缩合反应:
一分子氨基酸中的氨基与另一分子氨基酸中的羧基,消去一个水分子,经缩合反应而生成的产物叫肽。如两分子氨基酸可缩合成二肽:
写出丙氨酸缩合成肽的化学方程式:
⒋蛋白质的性质
⑴两性
⑵水解反应: 在酸、碱或酶的作用下,蛋白质能发生水解反应,最终生成氨基酸。
⑶盐析--盐析可用来分离、提纯蛋白质。
⑷变性
⑸颜色反应
向鸡蛋白质溶液中加入浓HNO3时,会产生 现象。
⑹灼烧时有烧焦的羽毛气味
5.酶--酶的催化作用具有以下特点: ⑴脱离生物体不会失去催化能力;⑵条件温和、不需要加热;⑶反应速度快、效率高; ⑷具有专一性、无副反应。
7.盐析:工业上利用油脂在碱性条件下水解生成高级脂肪酸的钠盐(肥皂的主要成分),反应完毕后可加入 进行盐析。
⒈油脂的定义: 。
常见的高级脂肪酸有: 、 、 。
⒉油脂的结构通式: 。在结构式中,R1,R2,R3相同的称为 ,不相同的称为 。天然油脂通常为 。
⒊油脂是 和 的合称。 在常温下呈液态,如:植物油。 在常温下呈固态,如:动物油。
⒋油脂的物理性质:
密度比水 ;不溶于 ,易溶于 ;粘度 ;油腻感;好溶剂;熔点 。
⒌油脂的化学性质
油脂是重要的供能物质。“油”所含“烃基”的饱和度低,则其熔点低,常温下呈液态。“脂肪”所含“烃基”的饱和度高,则其熔点高,常温下呈固态。所以,可以采用"加氢"的方法,把饱和度低的烃其变成饱和度高的烃基,从而将"油"变"脂肪"。
⑴氢化反应(硬化反应)
写出油酸甘油酯加氢的化学方程式:
⑵水解反应:
①酸性水解:
写出硬脂酸甘油酯酸性水解的方程式:
②碱性水解(皂化反应):
写出硬脂酸甘油酯碱性水解的方程式:
6.去污原理:用水作为主要清洗剂去污时,一般要加入适量的肥皂或洗涤剂,其中利用了 原理,肥皂或洗涤剂分子从结构上看可分为两部分,一部分为极性的“ ”,易溶于水,叫亲水基;另一部分是非极性的烃基,易和釉质相溶解,叫憎水基或亲油基,洗涤过程中,污垢中的油脂与肥皂或洗涤剂接触后, 基部分插入油滴使其互解互散,脱离被洗涤物。
4.多糖:
⑴淀粉:
①组成和结构:
②物理性质:
③化学性质:
a.无还原性
b.在稀酸作用下和人体中均能发生水解,最终产物为
c.淀粉遇碘变蓝.
⑵纤维素:
①组成与结构:
②物理性质:
③化学性质:
a.无还原性
b. 在 的硫酸和水浴加热的条件下能发生 反应,最终产物为 ,但比淀粉水解困难.
c.酯化反应:
(制硝化纤维)
3.二糖(分子式: )
⑴ 蔗糖和麦芽糖相似之处
①组成和结构的关系是 ,互为 体.
②都属于 糖,水解都生成 糖.
③水解产物的性质:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com