
科目: 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。
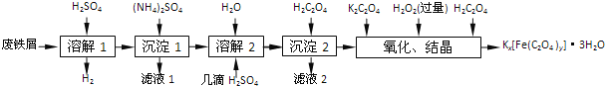
已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列判断不正确的是( )
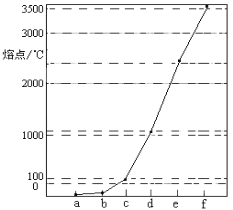
A. 图中对应的e、f单质晶体熔化时克服的是共价键
B. d单质对应元素的电子排布式:1s22s22p63s23p2
C. b元素形成的最高价含氧酸易与水分子之间形成氢键
D. 单质a、b、f对应的元素以原子个数比1∶1∶1形成的最简单分子中含2个σ键和2个π键
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域。已知:二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法正确的是( )
A. 二茂铁属于离子晶体
B. 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中碳环上有2个π键和5个σ键
,则其中碳环上有2个π键和5个σ键
D. 二价铁离子的基态电子排布式为:[Ar]3d44s2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: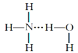
⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
A.4项B.5项C.6项D.7项
查看答案和解析>>
科目: 来源: 题型:
【题目】已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
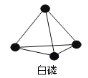
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
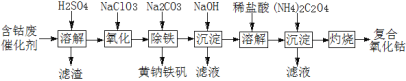
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
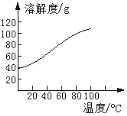
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
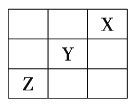
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】从冬青中提取出的有机物A可用于合成抗结肠炎药物Y及其他化学品,合成路线如下图:
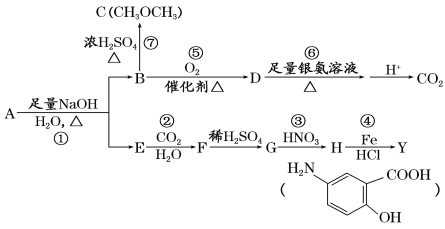
提示: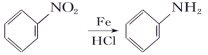
根据上述信息回答:
(1)请写出Y中含氧官能团的名称:__________________。
(2)写出反应③的反应类型:_________________。
(3)写出下列反应的化学方程式:
②______________。
⑤_______________。
(4)A的同分异构体I和J是重要的医学中间体,在浓硫酸的作用下I和J分别生成![]() 和
和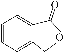 ,鉴别I和J的试剂为_________________。
,鉴别I和J的试剂为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com